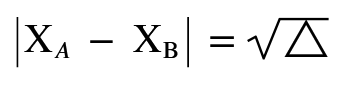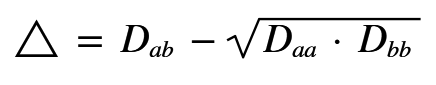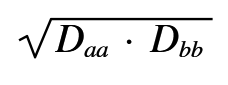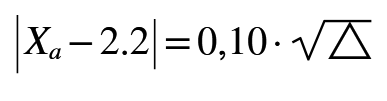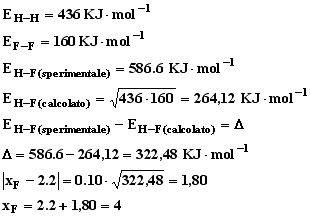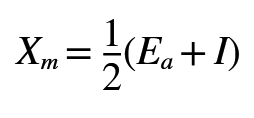To totally unlock this section you need to Log-in
Login
L'elettronegatività X (si legga "chi") è una grandezza che caratterizza il potere di attrazione di un atomo nei confronti degli elettroni di legame con un altro atomo; essa dipende sia dall'energia di ionizzazione che è relativa alla forza di attrazione esercitata da un nucleo verso i propri elettroni, sia dall'affinità elettronica che indica con quanta forza elettroni estranei possano essere attirati.
Per indicare il potere di attrazione di un elemento nei confronti dell'elettrone, si dovrà tener conto di entrambe le grandezze appena considerate e farne un bilancio; l'elettronegatività quindi deriva dalla combinazione dell'energia di ionizzazione e dell'affinità elettronica e indica il potere di attrazione di un atomo nei confronti degli elettroni di legame con un altro atomo.
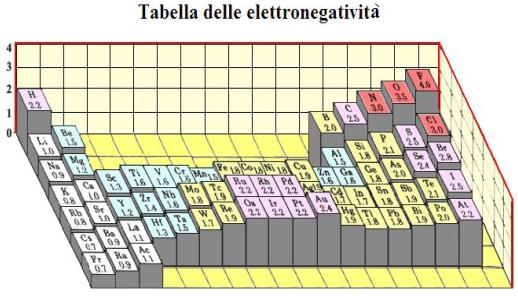
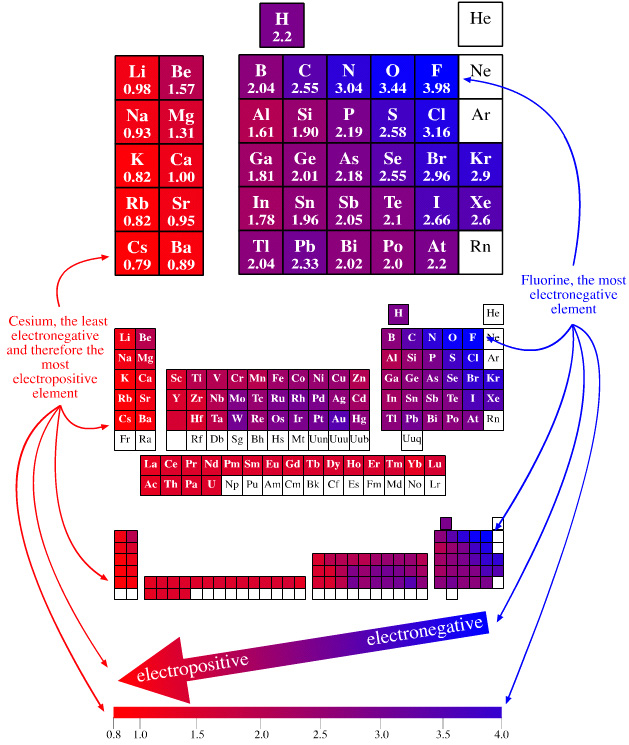
Tra i vari criteri utilizzati per calcolarla, il più diffuso è quello proposto dal chimico statunitense L. Pauling, che ha definito una scala arbitraria assegnando il valore minimo (0,7) al francio e massimo (4) al fluoro. Con questo metodo non è calcolabile l'elettronegatività dei gas nobili, per i quali si assume il valore 0 (per cui vengono chiamati anche gas inerti, utilizzati tipicamente per evitare lo svolgimento di reazioni chimiche indesiderate, ad esempio nella conservazione di sostanze chimiche altamente reattive e nella conservazione degli alimenti).
La densità elettronica associata a un legame a coppia di elettroni fra due atomi può presentare una disuguale ripartizione. In un numero molto grande di molecole, infatti, il centro di massa delle cariche positive dei nuclei dei due atomi non corrisponde al centro di massa delle cariche negative determinato dalla distribuzione della densità elettronica.
Questa disuguaglianza ripartitiva può essere messa in relazione con la natura dei due atomi legati. Esiste a questo scopo una grandezza chiamata elettronegatività definita come la tendenza di un atomo ad attirare verso di sé la nuvola elettronica nella formazione di un legame.
Scala di Pauling
Secondo la scala di Pauling, è possibile determinare l'elettronegatività di un elemento A (XA), conoscendo l'elettronegatività di un elemento B (XB) e applicando la seguente relazione:
in cui Δ è l'energia di risonanza ionico-covalente espressa in eV il cui valore è:
Dove:
D{ab} è l'energia di legame del composto A-B;
D{aa} è l'energia di legame del composto A-A;
D{bb} è l'energia di legame del composto B-B;
mentre il termine:
...rappresenta la media geometrica delle energie di legame dei legami covalenti puri A-A e B-B. Tale valore viene assunto come stima dell'energia dell'ipotetico legame covalente puro A-B.
In altre parole, l'energia di risonanza ionico-covalente (Δ) misura la differenza tra l'energia di legame reale e la stima teorica dell'energia di legame del composto A-B.
NOTA: Bisogna ricordarsi che questa scala si basa su misure dell'entalpia di legame e non è dotata di unità di misura. Pauling definisce l'elettronegatività come la capacità di un atomo, in una molecola, di attrarre a sé gli elettroni del legame.
Pauling ammette che la differenza di elettronegatività tra due elementi sia uguale alla radice quadrata di una quantità, detta energia di risonanza ionica-covalente espressa in eV (elettronVolt).
L'energia di risonanza ionica-covalente misura la differenza di energia tra il legame covalente reale AB ed un ipotetico legame covalente puro AB, la cui energia è assunta pari alla media geometrica delle energie dei legami covalenti puri AA e BB.
NOTA: Nel caso l'energia di legame sia espressa in kJ/mol o in kcal/mol è necessario applicare un coefficiente k di conversione (per trasformare in eV/particella), che vale rispettivamente 0,0103643 e 0,0433641.
Più esattamente Pauling propose di utilizzare la seguente equazione:
Dove:
Come esempio vediamo di calcolare l´elettronegatività del fluoro sapendo che:
NOTA:: l'energia di legame atomica viene tipicamente espresso in KJ/mol (chilo-Joule su mole).
Paulig utilizzando la formula empirica riportata sopra (|XA - 2.2| = 0.10·√Δ), riuscì a determinare l´elettronegatività di tutti gli elementi e notò che l´elettronegatività aumentava lungo un periodo e diminuiva lungo un gruppo vedi tabella:
Scala di Mulliken
Questa scala fu proposta da Robert S. Mulliken nel 1934. L'elettronegatività è definita semplicemente come la media aritmetica tra l'energia di ionizzazione e l'affinità elettronica:
Bisogna ricordare che l'energia di ionizzazione è differente dall'energia di legame, in quanto la prima riguarda l'energia necessaria ad allontanare un singolo elettrone (dall'orbitale più esterno) da un singolo atomo, mentre la seconda riguarda l'energia da somministrare ad un'entità molecolare per spezzare lo stesso legame, tra due atomi, di stessa o diversa specie (come ad esempio nel caso di una molecola di ossigeno o di cloruro, o tra un atomo di sodio ed uno di cloruro).
In generale, quando la differenza di elettronegatività tra i due atomi del legame è zero o vicina allo zero, avremo un legame covalente puro. Se questa differenza è superiore al valore di 1,7-1,8 e perciò sono nettamente diverse, il legame sarà ionico, nei casi intermedi il legame è covalente polare. Nelle molecole con legame polare, il baricentro delle cariche positive (o nuvola elettronica) non coincide con quello delle cariche negative e la molecola stessa si comporta come un dipolo elettrico, cioè contiene zone di carica opposta indicate con i simboli d+ e d-.
Elettropositività
E' un parametro empirico che esprime la tendenza di un elemento chimico a cedere elettroni, trasformandosi in ione positive. Tipicamente sono i metalli alcalini quelli più elettropositivi, come ad esempio il litio (Li) ed il potassio (K).